2022年10月14日,重庆医科大学附属第二医院陈压西/阮雄中教授团队在国际生物学氧化还原领域TOP期刊《Redox Biology》(IF: 10.787)在线发表了题为“ Selenoprotein K contributes to CD36 subcellular trafficking in hepatocytes by accelerating nascent COPII vesicle formation and aggravates hepatic steatosis ”的研究论文。该论文第一作者为重庆医科大学附属第二医院脂质研究中心(脂糖代谢性疾病重庆市重点实验室)博士研究生尤孟月,通讯作者为陈压西教授和阮雄中教授。

脂肪酸转位酶(CD36)是一种广泛表达的跨膜糖蛋白,在脂质代谢和信号转导中具有多种功能。异常升高的CD36增加肝细胞中脂肪酸的摄取和脂质积聚,促进非酒精性脂肪性肝病 (NAFLD)的发生发展。作为一种调节脂质代谢的多功能受体,CD36的功能与其亚细胞定位密切相关。棕榈酰化是最常见的脂质修饰之一,被认为可以调节跨膜蛋白的膜结合和稳定表达。硒蛋白家族成员硒蛋白K (SelK)是一种位于内质网膜中的单次跨膜蛋白,已被报道在多种蛋白质的棕榈酰化中发挥重要作用。SelK是否参与调节肝细胞中CD36的亚细胞定位以及CD36亚细胞转运的调控机制是一个有待探索的全新领域。
研究人员在喂食高脂饮食(HFD)的小鼠肝脏中观察到CD36在高尔基体和细胞膜中的分布增多,同时SelK表达水平显著增加。增加SelK可促进CD36向高尔基体和细胞膜转移,而降低SelK则使得CD36“滞留”在内质网中。此外,研究人员通过分析CD36在细胞膜的分布情况以及脂肪酸结合摄取功能发现SelK可通过影响CD36亚细胞定位参与调节CD36的脂肪酸摄取活性。
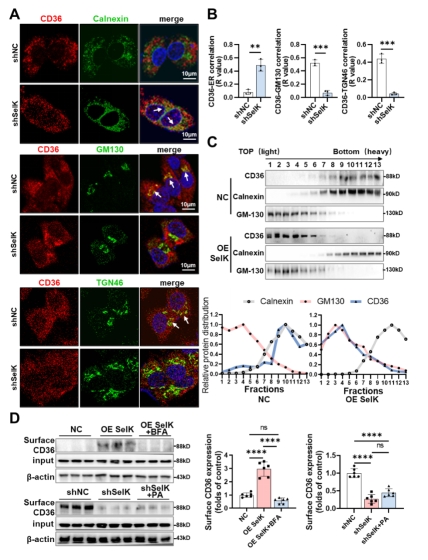
SelK影响CD36的亚细胞定位
在真核细胞中,蛋白质首先在内质网中合成和加工然后被运送到各个细胞器或细胞膜。包被蛋白复合物II (COPII)由一组高度保守的蛋白质组成,负责产生起源于内质网的小膜泡。其中,Sec23和Sec24组成紧密的异二聚体,负责形成COPII的内膜,而Sec13和Sec31形成COPII的外膜。Sar1和这两种类型的稳定复合物依次被募集到内质网膜的出口位点上,共同形成一个完整的COPII囊泡。
为了探索CD36 在细胞内转运的可能机制,研究人员通过免疫荧光和蛋白质免疫共沉淀技术发现喂食HFD小鼠肝脏中CD36与Sec24的结合增多。而抑制CD36棕榈酰化可以减少CD36进入COPII囊泡并改善小鼠肝脏损伤。研究人员随后检测了COPII形成过程中各组分变化,发现Sar1B在喂食HFD的小鼠肝脏和体外脂肪酸刺激下表达升高。SelK作为维持内质网相关蛋白稳态的重要分子,可以上调Sar1B的稳定性并促进Sar1B与其激动分子Sec12结合,触发新生COPII囊泡的形成从而加速CD36离开内质网。

棕榈酰化修饰促进CD36进入COPII囊泡
研究人员接下来探讨了SelK在介导CD36进入COPII囊泡中的作用。免疫共沉淀和免疫荧光分析显示,SelK可增加CD36与Sec24的结合和共定位。考虑到SelK可通过src同源性3结合域(SH3)与DHHC6棕榈酰基转移酶相互作用参与调节CD36棕榈酰化,研究人员体外构建了SelK SH3结合域截断突变体处理细胞后发现CD36的棕榈酰化、细胞膜分布以及高尔基体分布明显降低。最后,研究人员使用载有SelK全序列或SH3结合域截断突变体的腺相关病毒处理小鼠,发现缺失SelK SH3结合域降低小鼠肝脏的脂质积聚、抑制CD36与Sec24的结合及其在细胞膜的分布。

SelK调节CD36亚细胞转运的分子机制
综上所述,该研究表明,SelK的增加可加剧CD36的亚细胞转运,并加重肝细胞中的脂质积聚。其机制在于SelK参与调节COPII囊泡的组装过程,并加速棕榈酰化的CD36从内质网向高尔基体运输,从而促进了CD36在细胞膜的分布。干预SelK的SH3结合域可抑制CD36的亚细胞转运而改善小鼠NAFLD。因此,靶向肝细胞SelK可能是治疗NAFLD的一种新策略。
全文链接地址:https://doi.org/10.1016/j.redox.2022.102500
