撰文︱陈压西/阮雄中/杨萍团队
责编︱王思珍
肝脏是众多肿瘤转移的靶器官,肝转移癌恶性程度高并缺乏有效的治疗手段,严重影响肿瘤患者预后,是公认的医学难题。肝转移生态位微环境是影响肿瘤定植、转移及治疗反应的决定性因素。阐明肝脏免疫抑制微环境形成机制,寻找合适的靶点对其进行重置,属于肝转移癌研究领域的难点和热点问题。而到目前为止,肿瘤细胞信号如何塑造肝脏免疫抑制微环境尚不十分清楚。
近日,重庆医科大学脂质研究中心陈压西教授团队在Journal of Advanced Research杂志(IF=11.4)在线发表了题为“The fatty acid receptor CD36 promotes macrophage infiltration via p110γ signaling to stimulate metastasis”的最新研究成果。该研究在肝转移标本中发现了CD36+巨噬细胞的大量浸润,并揭示了肿瘤细胞通过分泌趋化因子CCL2从外周招募CD36+单核细胞进入肝脏, 塑造免疫抑制性肿瘤微环境,从而促进肝转移发生。重庆医科大学脂质研究中心秦虹博士、肖安华、卢倩楠、李乙玉硕士为该论文的第一作者,阮雄中教授、杨萍副研究员和陈压西研究员为该论文共同通讯作者。

肿瘤相关巨噬细胞是肿瘤微环境的重要组成部分,是一群丰度最高的“被策反”的免疫细胞,在早期致癌到肿瘤进展的过程中起着重要调控作用。巨噬细胞由于起源不同分为组织驻留的巨噬细胞和单核细胞衍生的巨噬细胞,研究提示不同来源的巨噬细胞可能具有不同的功能。首先,研究人员利用CIBERSORT解析了人肝转移癌的免疫细胞图谱,发现巨噬细胞大量浸润是肝转移癌的突出免疫特征。随后通过小鼠肝转移模型,研究人员证实了肝转移部位浸润的巨噬细胞主要起源于单核细胞,且是主要的促肿瘤样巨噬细胞亚型。进一步,利用免疫荧光和流式细胞术等,在肝转移癌临床及动物标本中均发现了CD36+单核衍生巨噬细胞的大量浸润。
团队前期已经证实脂肪酸转位酶CD36是促进巨噬细胞M2型极化的重要分子,由此推测募集而来的CD36+巨噬细胞极有可能是塑造免疫抑制微环境的重要原因。那么CD36+巨噬细胞浸润的调控机制是什么呢?研究人员分析了肺癌和黑色素瘤趋化因子的表达情况,发现这些肿瘤细胞大量分泌CCL2这一趋化因子。CCL2是单核细胞的强化学诱导剂,通过与CCR2受体相互作用,招募外周血单核细胞。有趣的是,CD36虽然不影响CCR2的表达,却能影响单核细胞对肿瘤细胞CCL2的趋化响应。髓系特异性敲除小鼠CD36通过CCL2/CCR2趋化轴抑制单核衍生巨噬细胞在肝转移癌中的浸润,从而减轻肝转移癌进展。
研究人员判断CD36可能调控CCR2下游信号通路影响单核细胞对CCL2的趋化响应。通过使用一系列激酶抑制剂阻断CCR2下游信号通路,发现仅p110γ特异性抑制剂显著削弱了CD36介导的单核细胞趋化。PI3K催化亚基p110γ在髓系细胞中特异高表达,是单核细胞趋化的重要调控因子。接着,通过脂质组学、脂筏组分分离等技术,研究人员解析了CD36通过改变细胞膜微结构域——脂筏的鞘脂组分,促进脂筏依赖的PI3K催化亚基p110γ趋膜活化,从而高响应肿瘤细胞CCL2/CCR2趋化信号。在小鼠肝转移动物模型上使用p110γ抑制剂,能抑制单核细胞浸润,恢复肿瘤免疫,并可以消除CD36缺失对肿瘤微环境的影响。
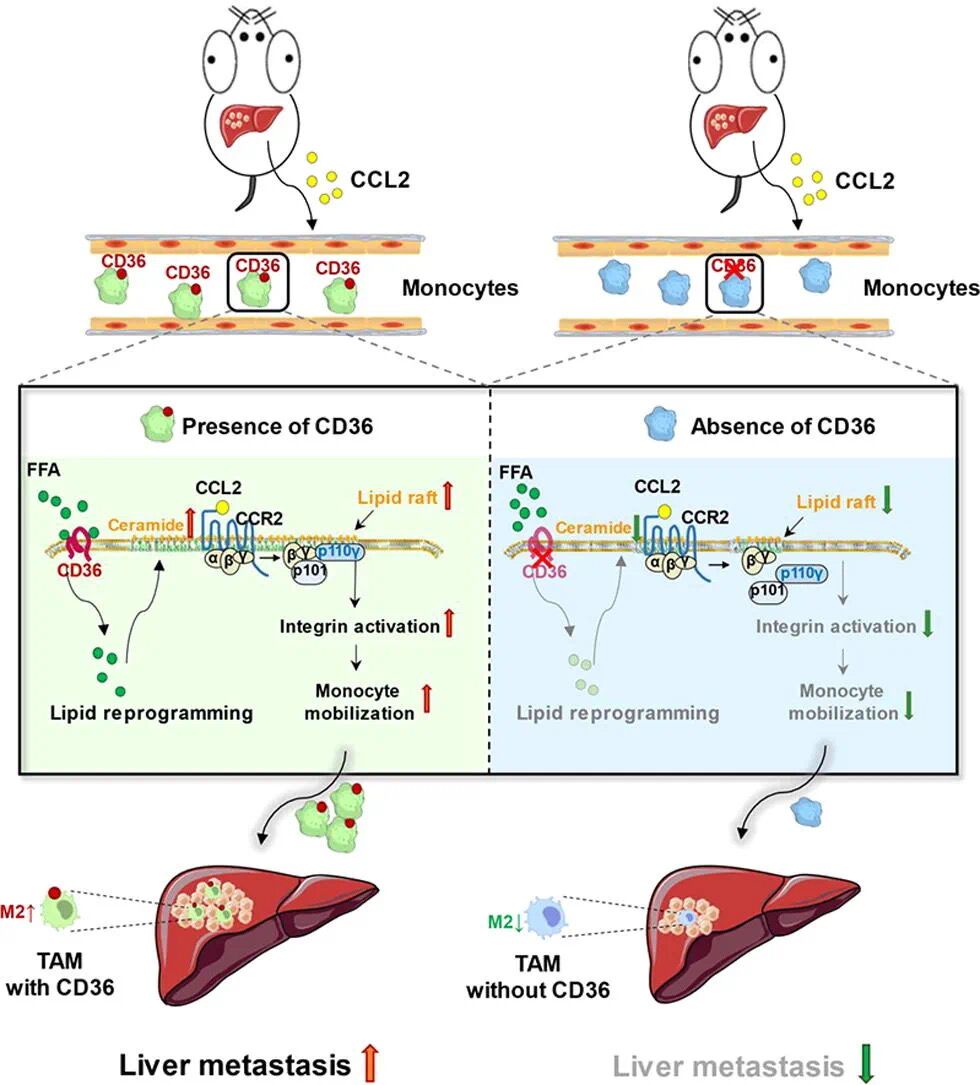
图解摘要描述了CD36如何通过激活p110y以脂质筏依赖的方式介导单核细胞动员,为靶向CD36治疗肝转移提供了治疗潜力。
综上所述,这项研究阐明了肿瘤细胞如何招募CD36+巨噬细胞重塑免疫抑制性微环境的分子机制,提示靶向CD36阻止单核衍生巨噬细胞浸润可能成为对抗肿瘤的有效手段,为肝转移癌免疫治疗提供了潜在的新型药物靶点。
原文链接1:JAR︱重庆医科大学陈压西/阮雄中/杨萍团队揭示肝转移癌免疫抑制微环境的新机制
原文链接2:https://authors.elsevier.com/sd/article/S2090-1232(24)00460-0
转载须知:本稿件为“岚翰生命科学”特邀稿件,且作者授权发布;本内容著作权归作者和“岚翰生命科学”共同所有;欢迎个人转发分享,未经授权禁止转载,违者必究。
